La
apoptosis es una forma de muerte celular, que está regulada genéticamente.
La muerte celular programada es parte integral del desarrollo de los tejidos tanto de plantas (
viridiplantae) como de animales pluricelulares (
metazoa). En animales, la forma de muerte celular programada más corriente es la "apoptosis". Cuando una célula muere por apoptosis, empaqueta su contenido citoplasmático, lo que evita que se produzca la respuesta inflamatoria característica de la muerte accidental o
necrosis. En lugar de hincharse o reventar y por lo tanto, derramar su contenido intracelular dañino enzimático, hacia el espacio extracelular-, las células en proceso de apoptosis y sus núcleos se encogen, y con frecuencia se fragmentan conformando vesículas pequeñas que contienen el material citoplasmático. De esta manera, pueden ser eficientemente englobadas vía
fagocitosis y, consecuentemente, sus componentes son reutilizados por
macrófagos o por células del tejido adyacente.
'Control del suicidio' celular

Una sección del hígado de un ratón mostrando una célula apoptósica indicada con una flecha.
Supervivencia
En los ciclos metabólicos, las células reciben y emiten moléculas. A estas señales, se las denomina
Señales de supervivencia, y son las responsables de mantener a la unidad biológica en un estado óptimo. En las comunicaciones celulares, estas señales están encaminadas a informar a la población celular cuando el medio no es propicio.
Proceso
Cuando el medio no es propicio, se ejecuta un programa de suicidio celular denominado apoptosis. Este programa produce la muerte de la célula de manera controlada. La unidad biológica no es capaz de sostener la
homeostasis. Las células más viejas cuentan con mitocondrias más dañadas, por lo que la capacidad de aportar ATP se ve mermada, si a eso le unimos las condiciones del medio, el resultado es evidente: Las más viejas son las que menos se alimentan en un medio precario. A su vez, la ralentización de los ciclos metabólicos descompensa otras funciones celulares, y lo que antes tenía una cancelación de cargas favorable para la vida, ahora ha de recurrir a otras formas de cancelar la carga, produciendo la expresión de genes que desemboca en la apoptosis.
Ejecución del programa genético
La apoptosis se caracteriza por: activación de caspasas, reducción del volumen celular, fragmentación nuclear (cariorrexis), exposición del lípido fosfatidilserina en la cara externa de la membrana plasmática, y formación de cuerpos apoptóticos. La ejecución en sí depende bien de factores externos a la célula (generalmente variaciones de concentración de factores de crecimiento, estímulos para la permanencia en el tejido o bien estímulos apoptóticos directos desde linfocitos) activando el ligando de FAS en la membrana celular, o bien de factores internos en los que la célula expresa metabólicamente su programa de muerte celular como consecuencia de un daño celular. Se debe matizar "daño", puesto que en este contexto, daño implica desde oxidación por radicales libres que la célula evalúa como irreparable hasta el acortamiento de telómeros debido a sucesivos ciclos de división celular, lo cual, en última instancia, produciría daño genético por pérdida de información en caso de nuevas divisiones celulares, pasando esta definición de "daño" por todos los que generan apoptosis, ninguno de los cuales sería suficiente para suspender el programa (en su caso hablaríamos de célula tumoral, es decir, aquella que debiendo ejecutar su programa de apoptosis no lo hace y continúa dividiéndose).
La apoptosis es un fenómeno biológico fundamental, permanente, dinámico e interactivo. Existen mecanismos pro- y anti-apoptóticos, regulados genéticamente, que actúan de forma activa (pues consumen energía) y equilibrada. Como función necesaria para evitar la sobreproducción celular se sospechaba de su existencia, pero es un proceso ordenado y "silencioso" que no produce reacción tisular y por ello difícil de captar. En
1972, Kerr y col., estudiando
orgánulos en células neoplásicas, detectaron que muchas células desaparecían en los cultivos. Esto llevó al estudio de imágenes cinemáticas que mostraron mediante microscopía electrónica las alteraciones que sufre la célula en un proceso que es de corta duración, durando en tales cultivos menos de una hora.
La apoptosis puede estar frenada, en equilibrio o estimulada. Por ejemplo, está frenada durante el desarrollo de
espermatogonias, en las criptas de las
glándulas intestinales (que es un
epitelio de crecimiento rápido) y durante la
lactancia en su período preparatorio, en que el tejido mamario aumenta su masa celular. Está en equilibrio respecto de la
mitosis en los tejidos adultos sanos. Es muy significativo su rol homeostático en la
médula ósea, donde debe destruir de manera constante la mitad de una inmensa cantidad de células que sólo en leucocitos significa 5 x 10
11 cada 24 h. Está estimulada cuando existen células envejecidas, mutadas, neoplásicas o no neoplásicas, alteradas por tóxicos y las que están en proceso de
metamorfosis o
atresia. Se ha estudiado esta condición en
neutrófilos envejecidos, en
megacariocitos con
citoplasma agotado por producción excesiva de plaquetas, en la atresia folicular del
ovario, en folículos pilosos en evolución y en la mama durante la involución post-lactancia.
Apoptosis y necrosis
Dos formas de muerte celular son habituales en el organismo: necrosis y apoptosis. Las características morfológicas de ambas permiten, en la mayoría de los tejidos, establecer claras diferencias.
A diferencia de la apoptosis, la necrosis es una forma de muerte celular que resulta de un proceso pasivo, accidental y que es consecuencia de la destrucción progresiva de la estructura con alteración definitiva de la función normal en un daño irreversible. Este daño está desencadenado por cambios ambientales como la
isquemia, temperaturas extremas y traumatismos mecánicos. En la apoptosis el proceso afecta a determinadas células, no necesariamente contiguas, y no a todas en un área tisular. La membrana celular no se destruye, lo que impide el escape al espacio extracelular de su contenido resultando un proceso "silencioso" sin inflamación. En el
citoplasma se produce granulación fina, con conservación de algunos
orgánulos, en especial las
mitocondrias que tienen un rol interactivo importante. A nivel nuclear la
cromatina se condensa. La membrana celular se recoge sobre las eminencias globuliformes que forman los elementos deteriorados del citoplasma y núcleo. Finalmente, fagocitos captan la célula en su totalidad impidiendo que se produzca alarma en el resto del tejido. Se ha demostrado, al menos en tejidos epiteliales, que si algo de material apoptótico escapa a la acción de los fagocitos es captado por células vecinas. La participación de células vecinas en este proceso se manifiesta además por la capacidad de éstas de enviar señales moleculares a la célula que debe morir como mecanismo complementario al que desarrolla la célula misma cuando se determina molecularmente su autodestrucción.
El proceso de apoptosis dura entre 30 minutos y varias horas en células en cultivo. El estudio e identificación específico de cuerpos apoptóticos se ha logrado con tinciones derivadas de la
uridina (TUNEL en que la U corresponde a uridina). Sin embargo, en algunas células como las
neuronas, la uridina tiñe también tejidos necróticos perdiendo la especificidad. En tales casos se recurre a anticuerpos monoclonales capaces de reconocer fragmentos de
ADN integrados en los cuerpos apoptóticos. La imagen que da la apoptosis al microscopio electrónico se caracteriza por la presencia de fragmentos de cromatina agrupados en conglomerados globuliformes, la granulación fina del contenido citoplasmático, la persistencia de algunos orgánulos hasta el final del proceso, como las mitocondrias, y la integridad de la membrana celular.
Mecanismo
Dado que la apoptosis actúa como oponente a la mitosis, es muy importante su relación con el
ciclo celular. En el ciclo celular hay cuatro fases: mitosis (M), fase de control celular G1, síntesis de ADN (S) y fase de control G2. La apoptosis puede iniciarse en el tercio final de G1 para impedir que una célula dañada ingrese a la fase de síntesis de manera que las mutaciones no se reproduzcan durante la replicación del ADN y en la fase G2 para impedir que las células que no hayan llegado a la madurez entren en mitosis.
En el mecanismo molecular que controla la apoptosis actúan varios agentes, de los cuales uno de los más importantes y mejor estudiados es el complejo de cisteinil-aspartato proteasas (
caspasas). Se han descrito 11 caspasas en células humanas que provocan una degradación proteica bien definida hasta llegar a la formación de cuerpos apoptóticos. Algunas caspasas son "iniciadoras" y otras "efectoras" del proceso catalítico, actuando sobre
endonucleasas que son las responsables directas de la fragmentación del ADN. La cadena de degradación proteica tiene sucesivos clivajes dependientes de la ubicación del ácido aspártico que se repite en la estructura de la enzima. Se han descrito varios cientos de sustratos de caspasas. La activación de las caspasas, que existen en calidad de pro-caspasas inactivas, se produce por diversas vías en que participan varios complejos moleculares.
Vía extrínseca
La vía extrínseca o de los "receptores de muerte" establece conexiones con el espacio extracelular, recibiendo señales proapoptóticas desde el exterior y de las células vecinas. Dos familias de receptores se han identificado con estas características: la
proteína Fas y el
factor de necrosis tumoral (TNF).
La proteína transmembrana Fas en su porción intracelular enlaza con un factor intermedio denominado FADD (factor associated death domain), nombre que sólo señala que está comprometido con la zona de la molécula Fas que participa en la muerte celular, activando las caspasas-8 y -10. En cambio, si la parte interna de la molécula se asocia a otro factor llamado DaXX, se activan proteín-kinasas que conducen al efecto contrario, es decir, estimulan el ciclo celular y la mitosis. Esta vía Fas permanece inactiva hasta que se produce en su parte externa el enlace con un cofactor llamado ligando Fas, proteína que actúa como detonador que enciende una vía en que sólo las caspasas están inactivas y el resto de la cadena está preparado para recibir el enlace exterior. Esta característica permite actuar con gran rapidez sin necesidad de sintetizar otros factores.
Algo similar sucede con el otro receptor de membrana TNF. Su porción intracelular conecta con proteínas como Tradd (TNF receptor associated death domain) y Raidd (receptor associated interleukine death domain) que activan caspasas "iniciadoras" de la apoptosis. Pero si se asocian a otro complejo llamado Traf (TNF receptor associated factor) activan proteín-kinasas y estimulan la proliferación celular, es decir, el efecto contrario.
Vía intrínseca o mitocondrial
Otra vía de inducción de apoptosis es la vía llamada mitocondrial. Las proteínas de la familia de
Bcl-2 regulan la apoptosis ejerciendo su acción sobre la mitocondria. La activación de proteínas pro-apoptóticas de la familia de Bcl-2 produce un poro en la membrana externa de las mitocondrias que permite la liberación de numerosas proteínas del espacio intermembrana; entre ellas, el
citocromo c.
El citocromo c, una vez en el citosol, activa un complejo proteico llamado "apoptosoma", que activa directamente a la caspasa-9. Una vez que la caspasa-9 está activada, ésta activa a las caspasas efectoras como la caspasa-3, lo que desencadena las últimas fases de la apoptosis.
Las proteínas de la familia de Bcl-2 se agrupan en tres familias: la familia de las proteínas antiapoptóticas (Bcl-2, Bcl-Xl, Mcl-1 y otras); la familia de proteínas proapoptóticas de tipo "multidominio" (Bax y Bak) y las proteínas proapoptóticas de tipo "BH3-only" (Bid, Bim, Bad y otras). Las proteínas tipo multidominio pueden producir poros por si solas en liposomas, lo que indica que probablemente son suficientes para formar el poro mitocondrial que permite la liberación del citocromo c. Las proteínas tipo
BH3-only activan a estas proteínas, y las antiapoptóticas inhiben la formación del poro. Estas proteínas son los reguladores más importantes del proceso de apoptosis.
Además de la salida de citocromo c desde la mitocondria, otra proteína llamada SMAC/DIABLO, que es inhibidor de los inhibidores de caspasas (IAPS) sale de la misma. Así se tiene una vía en la que la caspasa efectora está libre de actuar (dado que sus inhibidores fueron neutralizados por SMAC/DIABLO).
La vía mitocondrial puede conectarse también con la vía de receptores de muerte, ya que una vez activada la caspasa-8 por dichos receptores, esta caspasa activa a la proteína Bid, lo que provoca la apertura del poro mitocondrial y la activación de la caspasa-9.
Funciones de la apoptosis
Eliminación de tejidos dañados o infectados
La apoptosis puede ocurrir, por ejemplo, cuando una célula se halla dañada y no tiene posibilidades de ser reparada, o cuando ha sido infectada por un
virus. La "decisión" de iniciar la apoptosis puede provenir de la célula misma, del tejido circundante o de una reacción proveniente del
sistema inmune. Cuando la capacidad de una célula para realizar la apoptosis se encuentra dañada (por ejemplo, debido a una
mutación), o si el inicio de la apoptosis ha sido bloqueado (por un virus), la célula dañada puede continuar dividiéndose sin mayor restricción, resultando en un tumor que puede ser de carácter canceroso. Por ejemplo, como parte del "secuestro" del sistema genético de la célula llevado a cabo por los
virus del papiloma humano (VPH), un gen denominado E6 se expresa originando un producto que degrada la proteína
p53, vital para la ruta apoptótica.
También condiciones de estrés como la falta de alimentos, así como el daño del ADN provocado por tóxicos o radiación, pueden inducir a la célula a comenzar un proceso apoptótico. Pero no toda la muerte celular ocurre por apoptosis; también existe la necrosis, una forma descontrolada de muerte celular. Una ejemplo sería la necrosis mediada por la enzima nuclear, poli-ADP-ribosa polimerasa-1 (PARP-1), crucial en el mantenimiento de la integridad genómica. Un activación masiva de dicha enzima puede vaciar la célula de nucleótidos ricos en energía, provocando una cadena de transducción de señales del núcleo a la mitocondria que iniciaría la necrosis.
Desarrollo
Durante el desarrollo embrionario la apoptosis regula el crecimiento celular y tisular, desde la desaparición de las membranas interdigitales para el desarrollo normal de los dedos hasta la apoptosis en el ojo para la correcta formación del cristalino y los párpados pasando por multitud de procesos en estudio.
En los animales que pasan por distintos estadios la apoptosis que regula el desarrollo controla además el paso de un estado de crecimiento al siguiente (larva, ninfa, juvenil, adulto, etc.). En el caso de las ranas la apoptosis controla, durante la metamorfosis, la desaparición de la aleta caudal de los renacuajos.
Homeostasis
En un organismo adulto, la cantidad de células que componen un órgano o tejido debe permanecer constante, dentro de ciertos límites. Las células de la sangre y de piel, por ejemplo, son constantemente renovadas por sus respectivas células progenitoras. Por lo tanto, esta proliferación de nuevas células tiene que ser compensada por la muerte de otras células. A este proceso se le conoce como
homeostasis, aunque algunos autores e investigadores han sugerido
homeocinesis como un término más preciso y elocuente.
La homeostasis se logra cuando la relación entre la mitosis y la muerte celular se encuentra en equilibrio. Si este equilibrio se rompe, pueden ocurrir dos cosas:
- Las células se dividen más rápido de lo que mueren, desarrollando un tumor.
- Las células se dividen más lentamente de lo que mueren, produciéndose un grave trastorno de pérdida celular.
Ambos estados pueden ser fatales o potencialmente dañinos.
Regulación del sistema inmunitario
Ciertas células del sistema inmunitario, los
linfocitos B y
linfocitos T, son sofisticados agentes de la respuesta defensiva del organismo frente a infecciones así como células propias que hayan adquirido o desarrollado algún tipo de malignidad. Para llevar a cabo su trabajo, las células B y T deben tener la habilidad de discriminar lo propio de lo extraño y lo sano de lo enfermo, gracias a la especialidad de sus receptores. De hecho, los linfocitos T citotóxicos pueden ser activados por fragmentos de proteínas expresadas inapropiadamente (derivadas, por ejemplo, de una mutación maligna) o por
antígenos extraños producidos como consecuencia de una infección intracelular. Después de activarse tienen la capacidad de migrar, proliferar y reconocer las células afectadas, induciendo una respuesta de muerte celular programada.
Los receptores de las células B y T inmaduras no se generan por procesos de una elevada precisión, sino por procesos aleatorios de elevada capacidad para generar variabilidad. Esto significa que muchas de estas células inmaduras pueden no ser efectivas (porque su receptor no sea capaz de unir ningún antígeno conocido) o ser peligrosas para el propio organismo porque sus receptores sean capaces de reconocer con elevada afinidad antígenos propios. Si estas células fuesen liberadas sin otros procesamientos, muchas podrían volverse autorreactivas y atacar células sanas. El mecanismo por el que el sistema inmune regula este proceso es la eliminación tanto de los no efectivos como los potencialmente autorreactivos mediante apoptosis.
Como se ha descrito en los anteriores apartados, todos los tejidos dependen de una continua recepción de señales de supervivencia. En el caso de las células T, mientras se desarrollan y maduran en el timo, las señales de supervivencia dependen de su capacidad para reconocer antígenos extraños. Aquellas que no superan esta prueba, alrededor de un 97 % de las células T producidas, son eliminadas por apoptosis. Las supervivientes son testadas a su vez frente a antígenos propios, y aquellas que reconocen estos antígenos con elevada afinidad son eliminadas de la misma manera.
Por lo tanto, el desarrollo de un sistema inmune maduro y efectivo depende de una serie de reguladores positivos y negativos de las vías de apoptosis.
Patologías vinculadas con la apoptosis
La apoptosis es una función biológica de gran relevancia en la patogenia de varias enfermedades estudiadas hasta el momento. Podemos destacar el cáncer, malformaciones, trastornos metabólicos, neuropatías, lesiones miocárdicas y trastornos del sistema inmunitario.
- Enfermedades asociadas a inhibición de apoptosis
- Cáncer: linfoma no Hodgkin folicular (Bcl-2 +), carcinoma (p53 +), tumores hormono-dependientes
- Enfermedades autoinmunitarias: lupus eritematoso sistémico, glomerulonefritis autoinmunitaria
- Infecciones virales: Herpesvirus, Poxvirus, Adenovirus
- Enfermedades asociadas a aumento de apoptosis
- Sida
- Enfermedades neurodegenerativas: enfermedad de Alzheimer, enfermedad de Parkinson, esclerosis lateral amiotrófica, retinitis pigmentosa, degeneración cerebelosa
- Síndromes mielodisplásicos (MDS): anemia aplástica
- Daño isquémico: infarto de miocardio, apoplejía, daño por reperfusión, daño hepático por alcoholismo
Actualidad de la apoptosis
La apoptosis ha sido tema de creciente atención en la
Biología celular y en el estudio del desarrollo de los organismos, así como en la investigación de enfermedades tales como el
cáncer. Así lo demuestra el hecho que el premio Nobel año 2002 para Fisiología y Medicina fuese otorgado a Sydney Brenner (Gran Bretaña), H. Robert Horvitz (EE. UU.) y John E. Sulston (GB) "por sus descubrimientos concernientes a la regulación genética del desarrollo de órganos y la muerte celular programada







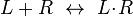
![K_d = \frac{[L][R]}{[L\! \cdot \!R]}](http://upload.wikimedia.org/math/c/f/b/cfb1b0beb4fdfb3f00a7718e79a8ac82.png)
![Fraccion \ Unida = \frac{1}{1+\frac{K_d}{[L]}}](http://upload.wikimedia.org/math/6/0/0/600f19e28a9d412d5d02e45789266f70.png)